1.緒言
ゲノム医科学の柱のひとつは、疾患関連遺伝子を同定し、ゲノム創薬に応用することである。疾患に関連する遺伝子の変異には、通常多型と呼ばれる遺伝によって受け継がれる変異と、突然変異と呼ばれる後天的に生じるものがある。多型は、一人一人における遺伝子の個体差であり、塩基の変異が人工の1%以上で出現するものを言う。ヒトゲノムDNA配列において最も一般的な多型は、一つの塩基の違いを意味する一塩基多型(SNPs)である。よって、ヒトゲノム計画によって解読され蓄積された情報から、多型の存在位置と疾患との関係を明らかにすることが待望されている。突然変異は、DNAに遺伝的変化をもたらし、新たな進化を生み出すが、同時に疾病の原因ともなる。中でも最も頻繁に現れるのが一塩基だけ変異が起こる点突然変異である。このようなSNPs解析技術や変異検出においては、いかに効率よく目的遺伝子とサンプル遺伝子における塩基配列の違いを見分けるかが鍵となる。
1970年代に開発されたハイブリダイゼーションアッセイでは、ニトロセルロースやナイロンのような柔軟性のある膜、放射性標識、およびオートラジオグラフィーが用いられた。1996年に開発されたDNAチップでは、ガラスなどの基板、蛍光標識、及び蛍光検出が用いられる。最近では、さらにDNAチップを高効率化したいくつかの革新的解析手法も提案されている。これら最新のSNPs検出法としては、DNA鎖上の塩基配列依存的電子移動検出による方法、サイクリックボルタンメトリーを用いて、一塩基のミスマッチを検出する方法6)、ミスマッチの融解挙動を蛍光で検出する方法や、ポリメラーゼによる伸長反応を色素によって検出する方法などがある。
しかし、DNAチップをはじめとして、現在研究が行われているこれらの遺伝子解析法では、いずれの場合においても、サンプルあるいはプローブDNAへの蛍光、電気化学的ラベル化が必要となる。このため、操作が複雑で、コストの面でも不利となるため、広い範囲での普及が困難となっている。また、これらの手法の共通点は、サンプルDNAとプローブDNAをハイブリダイゼーションさせた後、ハイブリッド形成量を解析するため、プローブ一個で一種類の遺伝子サンプルしか検出できないという欠点を有する。
そこで、本研究では、上記に述べた二つの問題点を解決するために、DNAのハイブリダイゼーション反応場として逆ミセルを利用した(Fig.1)。逆ミセルは、新しい機能を有するナノ分子集合体として、近年注目されている。特に、逆ミセルに可溶化された溶質はナノサイズの孤立空間により特異な性質を示すことが知られている。DNAがAOT逆ミセル中に可溶化される場合、二重らせん構造を取り得ることも明らかになっている。 本研究では、このような逆ミセルの特異環境中で、DNAのハイブリダイゼーションを行うことにより、上記の二つの問題点を解決することに成功した。本法は、蛍光などのラベル化を必要としないためUVで簡便に測定できる遺伝子解析法となる。しかもハイブリダイゼーションプロセスを追跡することで、1個のプローブで多種のサンプル遺伝子の同時解析が可能となる。本研究においては、実際に、p53癌抑制遺伝子を用いて、変異遺伝子の検出を試みたので以下に報告する。
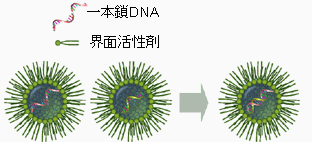
Fig. 1逆ミセル中でのDNAハイブリダイゼーション模式図
1.実験
1.1 試薬
p53癌抑制遺伝子の部分配列(20 mer)を選定し、Table 1に示すプローブDNAとサンプルDNAのカラム精製品を北海道システム・サイエンス(株)より購入した。これらの濃度は、それぞれのオリゴヌクレオチドの260nmにおけるモル吸光係数により算出した。界面活性剤は、市販のAOT(ジー2エチルヘキシルスルホコハク酸ナトリウム)(キシダ化学(株))を使用した。イソオクタン(キシダ化学(株))は、HPLCgradeのものをそのまま使用した。
p53は、癌抑制遺伝子であり、約50%に及ぶ癌において異常が検出されている。生体内においてこの遺伝子は、DNA障害を受けた細胞の複製をG1期で中止する働きがある。p53に欠失や変異が起こった細胞では、この中止機能が作用しなくなり、アポトーシスが誘導されない。p53変異のうち、80%以上を占めるのが、一塩基置換による点変異である。
1.2 実験操作
1.2.1 逆ミセルの形成
まず、有機相として、AOT濃度が50 mMになるようにAOT/イソオクタン溶液を調整した。この50mMAOT溶液1 mlを石英UVセルに取った.このUVセル内に、直接10 mM Tris, 1 mMEDTA(2Na), pH 7.0で調製した198μMの oligomer 1を含む水溶液9μlをピペットマンを用いて注入した.次に同様の水溶液で調製した198μMの oligomer2の水溶液 9μlをUVセル内に注入した。この場合W0=[H2O]/[AOT]は20となり、全有機相に対するoligomer1とoligomer 2の濃度はそれぞれ1.75μMになる。その後、このUVセルを数秒軽く振り、すぐに吸光度を測定した。同様に、上記で調製したAOT50mM溶液1 mlに一塩基変異をもつoligomer 4、oligomer 5、oligomer 6と二塩基変異をもつoligomer8を、oligomer 1を9μl注入した後9μl注入し、それぞれの逆ミセルサンプルを調製した。試料の調製は、いずれも測定直前に行った.
1.2.2 ハイブリダイゼーション過程の追跡
相補配列を有するオリゴヌクレオチドが取り込まれた逆ミセルを用いて、260nmにおけるDNAの吸光度の経時変化を測定した。吸光度変化の測定は、UV/VIS分光光度計(JASCO.V-560)を使用して、温度15℃において行った。
2.結果と考察
2.1 逆ミセル中におけるDNAハイブリダイゼーションのメカニズム
塩基対にミスマッチがあるとハイブリダイゼーションの速度、熱安定性のいずれも低下する。これらの低下は、塩基対におけるミスマッチの数、ミスマッチの位置に依存する。Fig.1に示したように、逆ミセルの内水相にDNAを取り込み、ハイブリダイゼーションを行うと、水溶液中に比べて結合速度が大きく抑制される。このため、フルマッチとミスマッチ間のハイブリダイゼーション速度に大きな差が生じる。つまり、ラベル化なしに、遺伝子の異常をUVで追跡できることになる。
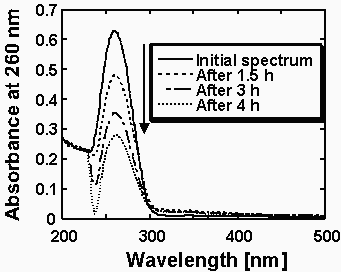
Fig. 2 逆ミセル中DNAハイブリダイゼーションのモニタリング
2.2 変異検出
逆ミセル中で同様の条件下、ハイブリダイゼーションを行うと、Fig. 2に示したように、時間の経過とともにゆっくり、DNAの吸光度が減少していくことが示された。逆ミセル溶液では、注入されたDNAサンプルは、体積比わずか2%程度の内水相に高い濃度のまま保持される.このため水相中でのDNA濃度は、200μMという高い濃度のままである.DNAのハイブリダイゼーションは平衡反応であるため、DNA濃度が高ければ高いほど、ハイブリダイゼーションの平衡が二本鎖形成に傾く。つまり逆ミセルという孤立空間にDNAを高濃度で閉じ込めることで、DNAハイブリダイゼーションの平衡は二本鎖形成側に傾く。
1本鎖DNAは、2本鎖形成に従い、吸光係数が減少するので、最大吸収波長(260nm)における吸光度変化を測定することによって、ハイブリダイゼーションの進行を追跡できる。Fig.4には、逆ミセル中での4つのサンプルDNAのハイブリダイゼーションの様子を示している。Fig.4の結果より、コントロールとしてのフルマッチのハイブリダイゼーション速度に比べ、末端の1カ所ミスマッチのoligomer5のハイブリダイゼーション速度がより遅くなることがわかる。さらに、中間部位の13位、7位にミスマッチがあるoligomer4、oligomer 6のハイブリダイゼーション速度は大きく低下した。また、2カ所にミスマッチがあるoligomer8は、すべての1カ所ミスマッチの場合よりその速度が遅くなった。これらの結果は、遺伝子の変異の有無のみならずその部位と数まで特定できる可能性があることを示唆している。
Probe 1 : 5´- GCTTTGAGGTGCGTGTTTGT - 3´
Target 1: 3´- CGAAACTCCACGCACAAACA - 5´
Target 2: 3´- CGAAACTCCACGAACAAACA - 5´
Target 3: 3´- CGAAACTCCACGTACAAACA - 5´
Target 4: 3´- CGAAACTCCACGGACAAACA - 5´
Target 5: 3´- CGAAACCCCACGCACAAACA - 5´
Target 6: 3´- TGAAACTCCACGCACAAACA - 5´
Target 7: 3´- CGAAACTCCATTCACAAACA - 5´
Target 8: 3´- CGAAACTCCTTTCACAAACA - 5´
(太字がミスマッチ部位)
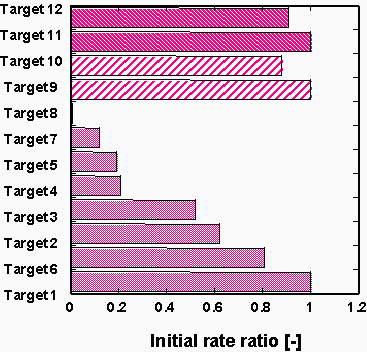
Fig. 3 様々なターゲットオリゴヌクレオチドとProbeとの比ハイブリダイゼーション速度
3. 結言
ナノ集合体である逆ミセルを利用した遺伝子解析法を提案した。本研究では、サンプルとして蛍光プローブを用いる必要がなく紫外可視領域の吸光度変化を追跡することによって容易に遺伝子の異常を知ることができる。これは逆ミセルに取り込まれたDNAが界面活性剤の核で隔離されているため、水中に比べてハイブリダイゼーションの速度が大きく抑制されることを利用している。塩基の配列に1カ所でも変異があると、正常DNAに比べてハイブリダイゼーションの速度が大きく低下することが明らかとなった
参考論文